الكتروفورز
نویسنده:
دکتر اسماعیل شریفی: متخصص مهندسی بافت، دانشگاه علوم پزشکی همدان
واژه الكتروفورز بيانگر حركت ذرات باردار تحت تاثير ميدان الكتريكي مي باشد. اساس اين فن استفاده از جابهجايي ذرات باردار در يك محيط مايع يا نيمه جامد تحت تاثير يك پتانسيل الكتريكي براي جداسازي ذرات و تركيبات مختلف به ويژه پروتئينها و پلي نوكلئوتيدها است. بسياري از مولكولهاي پراهميت زيستي از قبيل: اسيدهاي آمينه، پروتئين ها، نوكلئوتيدها و اسيدهاي نوكلئيك حاوي گروه هاي يونيزه شونده بوده بنابراين در هرpH اي در محلول بصورت گروه هاي باردار الكتريكي چه بصورت كاتيون( + ) و يا آنيون( – ) موجود مي باشند.
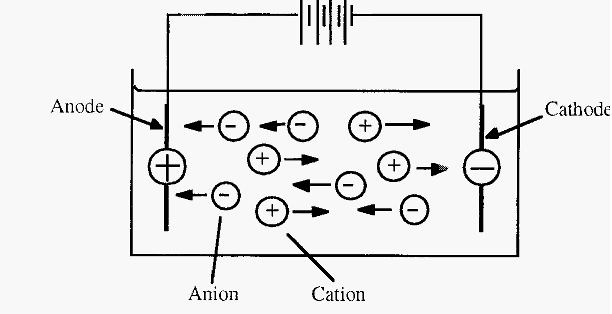
تصویر 1: حركت ذرات باردار در ميدان الكتريكي به هنگام الكتروفورز
تحت تاثير ميدان الكتريكي اين ذرات باردار به سمت كاتد و آند، بر اساس بار خالص شان حركت مي نمايند. وقتي پروتئينها در بافري با pH غير از pH ايزوالكتريك خود قرار ميگيرند، باردار ميشوند. اين مولكولهاي باردار در ميدان الكتريكي حركت ميكنند كه اين حركت بستگي به تراكم بار (نسبت بار به وزن) آن مولكولها دارد و هرچه اين تراكم بيشتر باشد مولكولها با سرعت بيشتري حركت ميكنند. الكتروفورز يكي از روشهاي بيوفيزيكي براي تعيين تعداد زير واحدها، جرم مولكولي نسبي و بررسي فرم طبيعي پروتئينها ميباشد.
تجهيزات مورد نياز براي الكتروفورز به طور كلي شامل دو قسمت مي باشد: منبع تغذيه و واحد الكتروفورز. واحدهاي الكتروفورزي براي ران نمودن سيستم هاي ژل به صورت عمودي و يا افقي موجود مي باشند. صفحات ژل عمودي به صورت روتين براي جداسازي پروتئين ها در ژل هاي اكريلاميد مورد استفاده قرار مي گيرند. ژل در بين دو صفحه شيشه اي كه از طريق گيره به هم متصل شده اند در حالي كه بوسيله spacer هاي پلاستيكي از هم جدا هستند، تشكيل مي گردد. بطور معمول از دستگاههاي mini gel استفاده مي شود ( شكل2). ابعاد ژل معمولاً cm 5/8 طول، cm 5 عرض و ضخامت mm1- 5/0 مي باشد. شانه پلاستيكي در محلول ژل قرار داده مي شود و پس از پليمريزه شدن ژل براي ايجاد چاهك ها برداشته مي شود. زماني كه دستگاه آماده شد، تانك بافر تحتاني الكتروفورز، پليت هاي ژل را در بر گرفته و تا حدي سبب خنك سازي پليت ها مي گردد.

تصوير 2: نمای یک تانک الکتروفورز عمودی
شماي كلي سيستم ژل افقي در شكل 3 نشان داده شده است. ژل بر روي صفحات شيشه اي و يا پلاستيكي قالب گيري شده و بر روي پليت خنك كننده ( يك سطح عايق كه آب سرد با عبور خود گرماي توليد شده را بيرون مي راند) قرار می گیرد. از طريق يك كاغذ فيلتر خیس ( wetted ) ضخيم، ارتباط ميان ژل و بافر الكترود برقرار مي گردد.
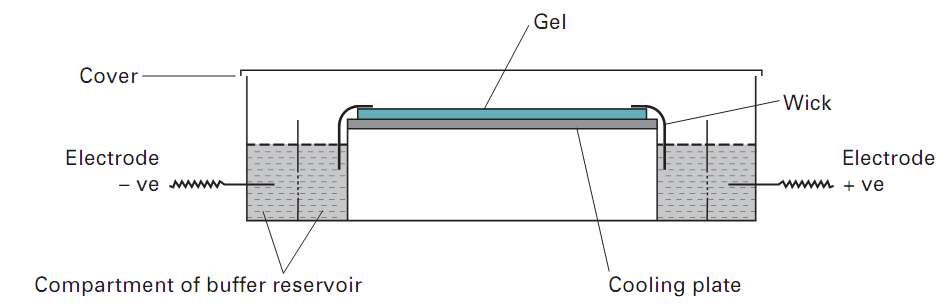
تصوير 3: نمای تانک الکتروفورز افقی
منبع تغذيه جريان را بين الكترودها در سيستم الكتروفورزي برقرار مي سازد. الكتروفورز رابايد در بافر مناسب انجام داد، بطوري كه مولكولهاي يونيزه جدا گردند. هرگونه تغيير در pH مي تواند سبب تغيير باركلي و تحرك پذيري( ميزان مهاجرت در ميدان اعمال شده ) مولكول هايي كه جدا سازي مي شوند ، گردد.
براي درك بهتر اينكه چگونه گونه هاي باردار مورد جداسازي قرار مي گيرند، لازم است فرمولهاي ساده مربوط به الكتروفورز را مورد بررسي قرار دهيم. هنگامي كه بين الكترودها كه با فاصله d از هم قرار دارند، پتانسيلي برابر vاعمال نماييم، گراديان پتانسيل ( E ) ايجاد مي گردد كه مساوي با اختلاف پتانسيل بين الكترودها تقسيم بر فاصله ميان الكترودها ( d ) مي باشد. با اعمال گراديان پتانسيلE ، نيروي وارد بر مولكولي با بار q ( كولن ) برابر با Eq (نيوتن) مي باشد. كه اين نيرو سبب حركت مولكول باردار شده از يك الكترود به يك الكترود ديگر مي گردد. اگرچه، نيروي مقاومت اصطكاك سبب تاخير در حركت مولكول باردار مي گردد، كه نيروي اصطكاك در اينجا، معياري از اندازه هيدروديناميك مولكول، شكل مولكول، اندازه روزنه هاي موجود در محيطي كه الكتروفورز انجام مي شود و ويسكوزيته بافر مي باشد. پس سرعت مولكول باردار( v ) در ميدان الكتريكي از رابطه زير محاسبه مي گردد:
V=Eq/f
كه f ضريب اصطكاك مي باشد. اغلب از واژه تحرک الكتروفورتيكي (µ) يك يون استفاده مي گردد كه نسبت سرعت يون به قدرت ميدان ( V/E) مي باشد.
μ=V/E=q/F
در رابطه فوق ،E ،V ،q، µ به ترتيب بار ذره، سرعت ذره، قدرت ميدان و تحرك الكتروفورزي است. رابطه تحرك الكتروفورزي در عمل براي يونها در رقت بينهايت كم در حلالهاي نارسانا صدق ميكند و از اين نظر با محدوديت مواجه است. در محلول آبي پلي الكتروليتي نظیر پروتئين، گروههاي واجد بار توسط ابري از يونها با بار مخالف احاطه ميشود و به اين ترتيب يك ميدان الكتريكي اضافي ايجاد ميگردد كه رابطه فوق را با اشكال مواجه ميسازد. متاسفانه پيچيدگي زياد محلولهاي آبي مانع توسعه تئوري شده است كه بوسيله آن بتوان تحرك پلي الكتروليت را در ميدان الكتريكي با دقت زيادي پيشگويي كرد. به طور كلي براي پروتئينها و ديگر پلي الكتروليتها كه واجد هم گروههاي اسيدي و هم بازي هستند، تحرك الكتروفورزي تابع pH ميباشد و در pH ايزوالكتريك (PI) تحرك الكتروفورزي مولكول صفر است.
زماني كه اختلاف پتانسيل در بين الكترودها اعمال مي گردد، مولكولهايي با بار كلي متفاوت از همديگر تفكيك مي شوند كه اين امر مربوط به تحرک هاي الكتروفورتيكي متفاوتشان است. مولكولهاي با بار مشابه در صورتي كه داراي اندازه هاي مولكولي متفاوت باشند نيز به علت تفاوت در نيروي اصطكاک، مي توانند از يكديگر تفكيك گردند. همچنانكه در ادامه مشاهده خواهيد نمود برخي از اشكال الكتروفورز بر مبناي تفاوت در بار مولكول ها جداسازي را انجام مي دهند در حاليكه در روش هاي ديگر اختلاف اندازه و در نتيجه نيروي اصطكاك سبب جداسازي مي گردد . در حد فاصل ميدان الكتريكي، قبل از اينكه مولكول هاي در مهاجرت در دستگاه الكتروفورز به الكترودها برسند، مولكولها بر اساس تحرك الكتروفورتيكي شان از هم تفكيك مي گردند. از اين رو الكتروفورز را مي توان يك فرم ناكامل الكتروليز ناميد. الكتروفورز به صورتهاي مختلفي انجام ميشود كه مهمترين آنها شرح داده ميشود. سپس نمونه هاي جداسازي شده را با استفاده از رنگ آميزي بوسيله يك رنگ مناسب و يا در صورتي كه نمونه ها توسط مواد راديواكتيو نشاندار شده باشند از طريق اتوراديوگرافي تشخيص داده مي شوند.
جريان الكتريكي بين الكترودها در محلول، عمدتاً توسط يون هاي بافر هدايت مي شود و قسمت خيلي كوچكي توسط يونهاي نمونه هدايت مي گردد. قانون اهم بيانگر رابطه ميان جريان ( I )، ولتاژ( V ) و مقاومت( R ) است:
V/I=R
با استفاده از اين رابطه مي توان گفت كه افزايش تفكيك الكتروفورتيكي با افزايش ولتاژ اعمال شده بدليل افزايش شدت جريان الكتريكي، امكان پذير است. فاصله طي شده توسط يونها متناسب با جريان الكتريكي و زمان است. به هر حال، توليد حرارت را نيز بايد مد نظر قرار داد. در حين الكتروفورز توان (w ، وات ) توليد شده در محيط از رابطه زير بدست مي آيد
W=I2Rسهم عمده اين توان توليد شده بصورت گرما از بين مي رود، گرماي ايجاد شده در محيط الكتروفورتيكي داراي اثرات زير است :
1 ) افزايش سرعت انتشار نمونه و يون هاي بافر منجر به پهن شدن نمونه هاي تفكيك شده مي گردند.
2 ) ايجاد جريان همرفت ، سبب مخلوط شدن نمونه هاي تفكيك شده مي گردد.
3 ) ناپايداري حرارتي در نمونه هاي حساس به گرما ديده مي شود. براي مثال اين امر سبب واسرشتي پروتئين ها و كاهش فعاليت آنزيمي مي گردد.
4 ) افزايش گرما سبب كاهش ويسكوزيته بافر مي شود، از اين رو كاهشي در مقاومت محيط ايجاد مي شود.
در صورتي كه ولتاژ ثابت اعمال گردد، افزايش جريان در حين الكتروفورز به دليل كاهش مقاومت ( معادله اهم را ببينيد ) وافزايش جريان سبب افزايش گرماي توليد شده مي گردد، به اين علت، اغلب از يك منبع تغذيه پايدار كه توان ثابتي را توليد مي نمايد بايد استفاده نمود و از اين رو نوسانات در گرما را مي توان حذف نمود.
هرچند توليد ثابت گرما نيز مشكل زا است، مي توان گفت كه مي شود الكتروفورز را در توان خيلي كم ( جريان كم ) براي غلبه بر مشكل توليد گرما انجام داد. اما اين امر سبب جداسازي ضعيف به دليل افزايش ميزان پخش ناشي از زمان طولاني تفكيك مي گردد. پس بنابراين بايد از توان مناسب براي زمان قابل قبول تفكيك استفاده نمود. اغلب به كمك سيستم هاي خنك كننده، گرماي ايجاد شده را حذف مي نمايند.
در صورتي كه چنين سيستم هايي نسبتاً بخوبي كار نمايند باز هم اثرات گرماي توليد شده كاملاً حذف نمي گردد.
فاكتور نهايي كه مي تواند جداسازي الكتروفورتيكي را تحت تاثير قرار دهد، پديده الكترواندواسمزيز ( Electroendosmosis ) كه تحت عنوان جريان الكترواسمز نيز شناخته مي گردد، مي باشد، كه به حضور گروه هاي باردار روي سطح محيط ارتباط دارد. براي مثال، كاغذ داراي گروه هاي كربوكسيل، آگارز داراي گروه هاي سولفات و سطح ديواره هاي شيشه اي مورد استفاده در الكتروفورز شامل گروه هاي سيلانول ( Si-OH) است. (شكل 4) چگونگي انجام اين پديده را در لوله هاي مويينه، نشان مي دهد.
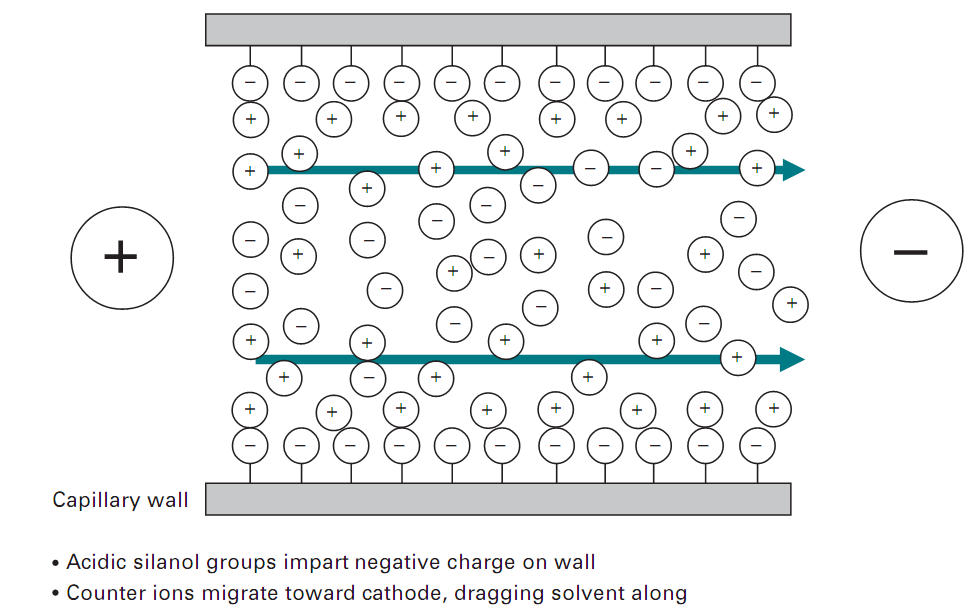
تصوير 4: شماتیک پدیده الکترواندوسموزیز
البته بايد در نظر داشت كه اين اصول براي تمامي محيط هايي كه داراي بار در سطح شان هستند يكسان است. در pH هاي بالاي 3 گروه هاي سيلانول برروي ديواره هاي لوله يونيزه مي شوند و داراي بار منفي مي گردند . كه اين بارها سبب ایجاد پدیده الكترواندوسموزيز مي شوند. گروه هاي سيلانول يونيزه شده يك لايه باردار در حد فاصل ديواره لوله و محلول الكتروليت ايجاد مي نمايند. با اعمال اختلاف پتانسيل، كاتيون هاي موجود در محلول الكتروليت كه در نزديكي ديواره لوله قرار دارند به سمت كاتد مهاجرت مي نمايند و محلول الكتروليت را با خود مي كشند و سبب ايجاد جريان الكترواسمز به سمت كاتد مي گردند.
محیط حمایت کننده (Support media)
اولين بار الكتروفورز پروتئين در محلول آزاد (free soloution) توسط Arne Tiselius ( كه به اين خاطر وي برنده جايزه نوبل شيمي در سال 1948 گرديد )انجام پذيرفت. اما خيلي زود مشخص شد كه اين روش داراي مشكلات بسياري است. بويژه، اثرات نامطلوب جريان هاي همرفت و پخش را مي توان با پايدارسازي محيط كاهش داد. كه اين عمل را مي توان از طريق الكتروفورز بر روي حمایت کننده هاي فیزیکی متخلخل، كه داخل بافر الكتروفورز تر شده اند انجام داد.
اولين ساپورت مورد استفاده كاغذهاي فيلتر يا نوارهاي استات سلولزي بود كه داخل بافر تر شده بودند. امروزه اين محيط ها به ندرت مورد استفاده قرار مي گيرند، اگرچه استات سلولز هنوز هم كاربرد دارد .
بويژه براي ساليان متمادي مولكول هاي كوچك مانند اسيدهاي آمينه، پپتيدها و كربوهيدرات ها بوسيله الكتروفورز بر روي ساپورت هايي مثل كاغذ و يا صفحات نازك سلولز، سيليكا و آلومينا تفكيك و آناليز مي گرديد. هر چند اين تكنيك ها هنوز هم قابل استفاده مي باشند، براي آناليز چنين مولكول هايي امروزه تمايل به استفاده از تكنيك هاي مدرن و حساس مثل كروماتوگرافي مايع با كارايي بالا (HPLC ) مي باشد. اگر چه كاغذ و يا ساپورت هاي لايه نازك براي جداسازي مولكول هاي كوچك مناسب هستند اما جداسازي ماكرومولكولهايي مثل پروتئين و اسيدنوكلئيك بر روي چنين ساپورت هايي خيلي ضعيف است. به هر حال، آغاز استفاده از ژل ها به عنوان محيط هاي مورد استفاده در الكتروفورز، بسرعت باعث توسعه روش های مختلف آنالیز ماکرومولکول ها می گردد. اولین ژل مورد استفاده در الكتروفورز ژل نشاسته بود، هرچند امروزه نيز در برخي موارد از آن استفاده مي شود. امروزه بيشتر از ژل هاي آگارز و پلي اكريلاميد در الكتروفورز استفاده مي شود.
ژل هاي آگارز
آگارز يک پلي ساكاريد خطي (با جرم مولكولي نسبي 12000 دالتون) مي باشد كه از واحدهاي تكرار شونده پايه آگاروبيوز ( كه شامل واحدهاي يك در ميان گالاكتوز و 3 و 6- انهيدروگالاكتوز مي باشد ) ساخته شده است (شكل5) آگارز يكي از تركيبات آگار مي باشد، آگارز معمولاً در غلظت هاي 1% و 3% مورد استفاده قرار مي گيرد. ژل هاي آگارز با معلق كردن آگارز خشك در بافر آبي و جوشاندن مخلوط تا ايجاد يك محلول شفاف، شكل مي گيرند، سپس محلول روي بستري ريخته شده و اجازه داده مي شود تا در دماي اتاق سرد شود و از این طريق ساختار ژل محكم مي شود.
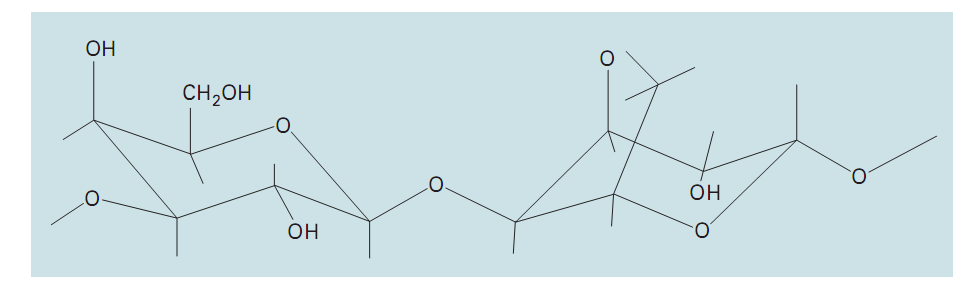
تصوير5: ساختار مولکولی آگارز
خواص ژل، به پيوندهاي هيدروژني درون مولكولي و بين مولكولي ميان زنجيره هاي بلند آگارز بستگي دارد، روزنه هايي با اندازه بزرگ از غلظت هاي پايين ژل و روزنه هايي با اندازه كوچك از غلظت هاي بالاتر ژل حاصل مي گردند. ژل هاي آگارز براي الكتروفورز پروتئين ها و اسيدهاي نوكلئيك مناسب هستند.
در الكتروفورز پروتئين ها، اندازه نسبي ژل 1% آگارز در قياس با اندازه پروتئين ها بزرگ تر است. و از ژل هاي آگارز در تكنيك هايي مانند flat bed isoelectric focussing كه در اين روش پروتئين ها اصولاً بر مبناي بار طبيعي خود در ماتريس ژل حركت مي نمايند، استفاده مي شود. اندازه روزنه و مولكول با يكديگر بسيار قابل قياس اند و نيروي اصطكاك نقش مهمي در جداسازي مولكول ها دارد. مزيت عمده ژل هاي آگارز، در دسترس بودن آنها در دماي ذوب پايين ( ℃65 – 62 ) است. پس بنابراين مي توان اين ژل ها را با حرارت دادن در دماي ℃ 65 دوباره مايع نمود و از اين رو، براي مثال نمونه هاي DNA كه در ژل جداسازي شده اند را از ژل خارج ساخت و در محلول آنها را بازيافت نمود.
ژل هاي پلي اكريلاميد
انجام عمل الكتروفورز در ژل هاي آكريل آميد را به صورت خلاصه باPAGE نمايش مي دهند كه مخففpoly acrylamide gel electrophoresis مي باشد. ابعاد منافذ این ژل ها به طور مشخص قابل كنترل ميباشد. در اين روش جداسازي ذرات يا مولكولهاي واجد بار هم بر اساس فيلتراسيون ژلي و هم بر اساس تفاوت در بار الكتريكي ذرات مي باشد. در اين نوع الكتروفورز، ژل حركت مولكولهاي بزرگ را در مقايسه با انواع كوچك با تأخير مواجه ميسازد. در حالي كه اين پديده عكس وقايعي است كه در كروماتوگرافي ژلي رخ ميدهد. ژل هاي پلي اكريلاميد از پليمريزه شدن مونومرهاي آكريل آميد در حضور مقادير كم ازN و /N – متيلن بيس آكريل آميد ( بيس آكريلاميد ) تشكيل مي گردند( شكل6). كه اين واكنش از طريق تشكيل راديكال هاي آزاد آغاز مي گردد.
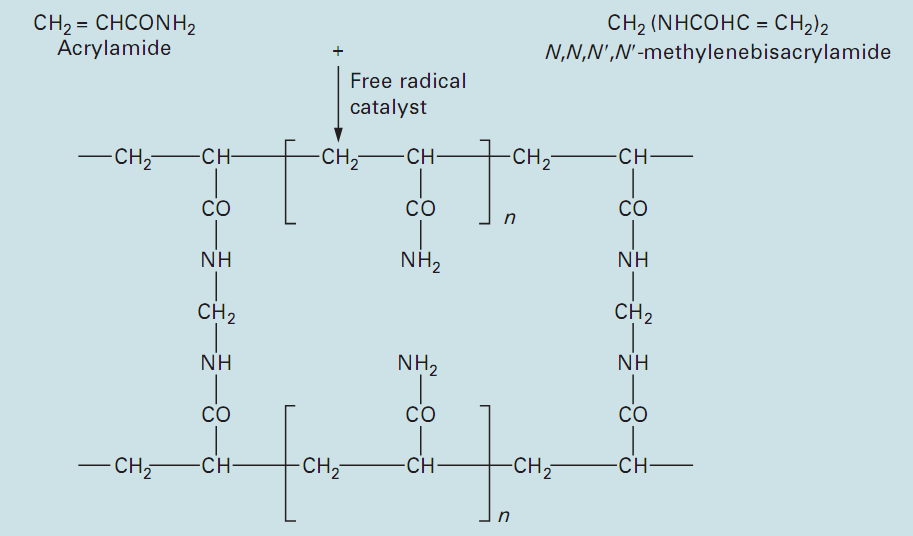
تصویر 6: تشکیل ژل پلی آکریل آمید از آکریل آمید و بیس آکریل آمید
يك روش ديگر كه براي پليمريزه نمودن ژل هاي آكريل آميد استفاده مي شود، پليمريزاسيون نوري است. كه در اين روش از ريبوفلاوين استفاده مي گردد، زماني كه ژل در مجاورت نور به مدت 2 الي 3 ساعت قرار مي گيرد، تجزيه نوري ريبوفلاوين، سبب توليد راديكال هاي آزاد مي گردد كه واكنش پليمريزاسيون را آغاز مي نمايند. اندازه روزنه در ژل هاي آكريل آميد با تغيير غلظت آكريل آميد و بيس آكريل آميد تغيير مي نمايد. ژل هايي با درصد پايين آكريلاميد( براي مثال 4% ) داراي اندازه روزنه بزرگ مي باشند و اين نوع ژل ها را مي توان در الكتروفورز پروتئين ها استفاده نمود. اين گونه ژل ها را مي توان براي جداسازي DNA نيز مورد استفاده قرار داد.
ژل هايي كه درصد آكريل آميد آنها بين 10 تا 20 درصد است در تكنيك هايي نظير الكتروفورز ژل سديم دودسيل سولفات استفاده مي شوند. اندازه روزنه هاي كوچك داراي اثر غربال گري مي باشند كه مي توان از اين طريق پروتئين ها را بر اساس اندازه شان جداسازي نمود. جداسازي پروتئين ها اساساً بر روي ژل هاي پلي آكريل آميد پليمريزه شده در لوله هاي شيشه اي كه داراي قطر 7 ميلي متر و طولي در حدود cm10 هستند، انجام مي پذیرد. كه پرسازي و استفاده از اين لوله ها بسيار ساده است و با حداقل امكانات ، انجام پذير مي باشد. اما به ازاي هر لوله تنها مي توان يك نمونه را جداسازي نمود و از آنجايي كه شرايط جداسازي از يك لوله به لوله ديگر مي تواند متفاوت باشد، مقايسه بين نمونه هاي مختلف هميشه دقيق نيست. با استفاده از تكنيك هايي چون ژل هاي صفحه ای عمودي مي توان همزمان 20 نمونه را طي شرايط يكسان در يك مرحله ران نمود. امروزه از ژل هاي صفحه اي عمودي بصورت روتين براي آناليز پروتئين ها و جداسازي قطعات DNA در حين آناليز سكانس DNA استفاده مي گردد. در ژل الكتروفورز لولهاي، ژل را در لوله آماده كرده، لوله را در دستگاه به گونهاي قرار ميدهيم كه بالا و پائين آن بافر باشد. بافر در مخزن بالا و پائين و همينطور بافر ژل واجد pHاي است كه در آن ماكرومولكول داراي بار خالص منفي است. از اينرو از سمت آند در مخزن بالايي به سمت كاتد در مخزن پائيني حركت ميكند.
محلول ماكرومولكول به صورت لاية نازكي در بالاي لوله روي ژل قرار ميگيرد. محلول ماكرو مولكول معمولاً شامل چندين تركيب با تحرك مختلف است كه توسط الكتروفوز جدا ميشود. جابهجايي رنگ نشاندهنده انجام فرايند است و براي برآورد ميزان تحرك به كار ميرود. نمونه ماكرو مولكولي كه به ژل PAGE مننتقل ميشود بايد حاوي تركيبي خنثي نظير ساكارز و گليسرول باشد به طوريكه محلول حاوي اين تركيبات واجد دانسيته مناسبي ميشود و از انحلال نمونة حاوي ماكرومولكول در مخزن بافري بالايي جلوگيري ميكند.
در نمايانسازي باندها به روش رنگآميزي ابتدا بايد پروتئين يا هر نمونة ديگر در ژل تثبيت (fix) شود و براي تثبيت نمونه، ژل را براي مدتي در محلول الكلي يا محلول اسيدي ضعيف و يا مخلوط اين دو غرق ميكنند. بعد از تثبيت نمونه در ژل به منظور نمايان ساختن باندهاي پروتئيني ميتوان از محلول تركيبي موسوم به كوماسيبلو (Coomassie brilliant blue) استفاده نمود. هرگاه مقادير نمونة پروتئيني كه به منظور الكتروفورز به ژل منتقل ميشود خيلي كم باشد از روش رنگآميزي به مراتب حساس تری موسوم به روش رنگآميزي نيترات نقره استفاده ميشود. روش نيترات نقره حدود 50الی 100 بار حساستر از روش رنگآميزي با كوماسيبلو است.
براي نمايان ساختن باندها روش ديگري موسوم به روش فلورسامين نيز وجود دارد. در اين روش از تركيب غيرفلور سنتي موسوم به فلورسامين استفاده ميشود و اين تركيب ضمن واكنش با آمينهاي نوع اول محصولي ايجاد ميكند كه زيرنور ماوراءبنفش (UV) فوقالعاده فلورسنت است.
اگر نمونه واجد خاصيت راديواكتيو باشد، در جوار فيلم X-ray، نمونه راديواكتيو اثرات سياهي را بر جاي ميگذارد كه جايگاه مواد راديواكتيو نشان ميدهد. اين روش به اتوراديوگراف معروف است.
