تفسیر نتایج مس اسپکترومتری
در دستگاه MS ، دتکتور سیگنالهای به دست آمده از یونها را جذب و تقویت کرده و سپس جهت پردازش به مرکز پردازشگر دستگاه ارسال می کند. نهایتاً اطلاعات به صورت منحنی ( اسپکتروم و یا درحالت جمع به صورت اسپکترا ) که محور طولی آن میزان نسبت m / z و محور عرضی آن شدت ( Intensity ) رانشان می دهند نمایش داده می شود.
برای تفسیر اسپکترای به دست آمده به مثالهای زیر توجه کنید .
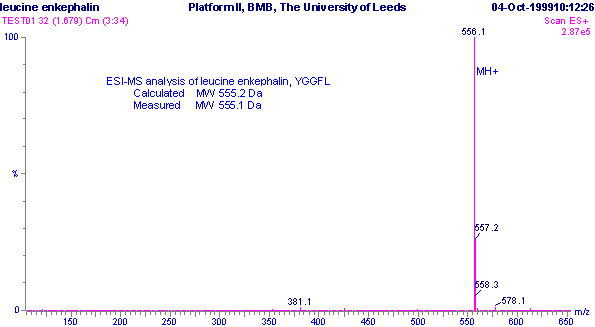
تصویر 1: اسپکترای به دست آمده از پپتیده کوتاه YGGFL . فرمول مولکولی ماده به صورت C28H37 N5O7 است و وزن مولکولی محاسبه شده Da 555.2692 است(Ref: Alison E.Ashcroft, http://www.astbury.leeds.ac.uk/facil/MStut/mstutorial.htm ) .
اسپکتروم غالب که عدد 556.1 را به عنوان m / z نشان می دهد مربوط به پپتید کامل یونیزه شده است که با اضافه شدن یک پروتون [ H + ] به آن و بدلیل داشتن یک بار مثبت نسبت m / z به این صورت درآمده است که همخوانی زیادی با وزن مولکولی محاسبه شده دارد.
اسپکتروم های دیگری نیز در تصویر دیده می شود. اسپکتروم 557.2m/z که تقریباً با شدت 25 % نسبت به پپتید کامل قرار دارد و اسپکتروم 558.3 که کمتر از 10% شدت پپتید کامل را دارد. این اسپکتروم ها نیز مربوط به پپتید کامل هستند با این تفاوت كه در ساختارآنها ایزوتوپ های دیگر اتمها قرار گرفته اند. برای مثال در اسپکتروم 557.2 به جای یک اتم C12 ، اتم C13 قرار گرفته که باعث شده نسبت به اسپکتروم پپتید کامل یک واحد ( Da ) افزایش نشان دهد . شدت این اسپکتروم ( 25 % ) بستگی به فراوانی ایزوتوپ C13 در طبیعت نسبت به C12 دارد. اختلاف یک واحدی این اسپکتروم با پپتید کامل نشان می دهد که پپتید تنها به صورت تکبار یونیزه شده است . در غیر اینصورت اگر به طور مثال دوبارمثبت گرفته بود باید اختلاف دو اسپکترا 5/0 واحد می شد . در ناحیه انتهایی این تصویر اسپکتروم 1/578 m/z را می بینیم . این اسپکتروم مربوط به ذره یونی پپتیدی اضافه شده به اتم سدیم است (Sodium adductions ).
در این حالت وزن مولکولی ذره و وزن اتمی سديم ( M + Na+ ) تشکیل دهنده این اسپکتروم خواهد بود . یونهای دیگر مانند ( 39+ )K+ ، ( 18 + ) +4NH و ( 35 + ) CI نیز ممکن است با اضافه شدن به ذره یونی مورد آزمون اسپکترا ایجاد نمایند .
مس اسپکترومتری ESI یک روش یونیزاسیون نرم ( Soft ) را در بر می گیرد . در این سیستم مولکولهای پروتئین یا پپتیدها با گرفتن پروتون ( بصورت یون مثبت در حالت یونیزاسیون مثبت ) و یا با از دست دادن پروتون ( بصورت یون منفی در حالت یونیزاسیون منفی ) یونیزه می شوند . مولکولهای بزرگتر از Da 1200 ممکن است واجد چندین جایگاه شارژی گردند ( Multiply charged ) . در تصویر زیر اسپکترای لیزوزیم بدست آمده از سفیده تخم مرغ و در مس اسپکترومتر ESI نشان داده می شود . نمونه در محلول استونیتریل : 01/0 % اسید فرمیک آبی که به نسبت 1 : 1 ( v / v ) تهیه شده مورد آنالیز قرار گرفته است.
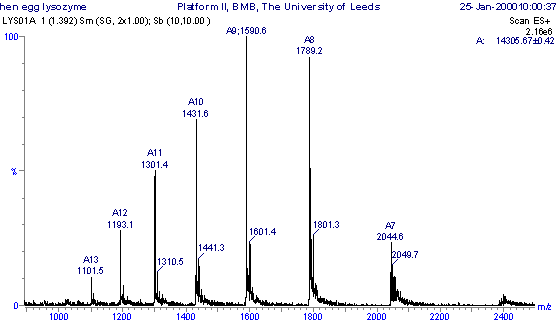
تصوير 2: اسپكتراي ESI-MS پروتئين ليزوزيم سفيده تخم مرغ (Ref: Alison E.Ashcroft, http://www.astbury.leeds.ac.uk/facil/MStut/mstutorial.htm )
در اینجا رزولوشن آنقدر بالا نرفته که تمام اسپکترومهای مربوط به ایزوتوپها نشان داده شوند به همین دلیل هر کدام از اسپکترومها در انتها ناحیه پهنتری را نسبت به تصویر 1 نشان می دهد . تمام اسپکترومها در اینجا نماینده پروتئین هستند که هر کدام با تعداد پروتون مشخص شارژ شده است. چون وزن مولکولی پروتئین ثابت است ( MW= 14305.14 Da ) اسپکترومهای کوچک نماینده آنهایی هستند که جایگاه شارژی بیشتری دارند .
رابطهm / z در اینجا می تواند بصورت زیر نوشته شود .
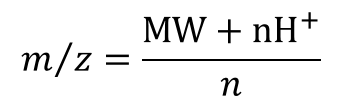
MW = وزن مولکولی پروتئین ، n = تعداد جایگاه شارژی ، H = وزن اتمی پروتون ( Da 008/1 )
اگر تعدادجایگاه شارژی در هر اسپکتروم معلوم بود به راحتی می توانستیم با قراردادن n و m / z ( که همان عدد بالای هر اسپکتروم است ) در رابطه فوقMW پروتئین را بدست آوریم. اما از آنجا که عدد n را نداریم از این قاعده که هر دو اسپکتروم مجاور تنها به اندازه یک n از یکدیگر متفاوت هستند می توانیم MW را محاسبه کنیم .
برای مثال اگر اسپکتروم 6/1431 به اندازه n جایگاه شارژی داشته باشد ، اسپکتروم 4/1301 به اندازه 1 + n عدد شارژی خواهد داشت . بنابراین رابطه m / z را برای ایندو و بصورت زیر می نویسیم
( 1 + n ) / [ ( 1 + (n ( + MW ] = 4/1301 و n / ( +nH + MW ) = 6/1431
بنابراین روابط فوق را طوری می نویسیم که MW حذف شود
H + (1 + n ) – 4/1301 ( 1 + n ) = + nH – ( 6/1431 ) n
+ H- 4/1301 + ( 4/1301 ) n = ( 6 / 1431 ) n
+ H – 4/1301 = ( 4/1301 – 6/1431 ) n
( 4/1301 – 6/1431 ) / ( + H – 4/1301 ) = n
بنابراین عدد شارژی در اسپکتروم 6/1431 عدد 10 خواهد بود (n=10) .
قراردادن 10 = n در رابطه n ( + NH + MW ) = 6/1431
باعث می شود تا عدد Da14035.9 برای وزن مولکولی ( MW ) محاسبه شود که بسیار نزدیک وزن مولکولی محاسبه شده تئوریک ( Da14 . 14305 ) می باشد . زمانی که مولکولهای با چند جایگاه شارژی مورد آزمون MS قرار می گیرند اسپکترومهای مربوط به ایزوتوپها قابل تفکیک نیستند و وزن مولکولي ماده مورد سنجش بصورت متوسط نمایش داده می شود .
میزان صحت اندازه گیری جرم ( Mass accuracy ) دستگاه تعیین می کند که عدد m / z در چه محدوده ای ( – / + ) قرار می گیرد . برای مثال صحت دستگاه ESI در حد % 01/0 است .یعنی برای مولکول لیزوزوم این میزان برابر با Da4/1 +14 / 14305 خواهد بود .
برای آسان شدن آنالیز اسپکترای بدست آمده از یک مولکول با چند جایگاه شارژی ، این اطلاعات می تواند بصورت پروفایل وزن مولکولی ( Molecular mass profile ) نمایش داده شود ( تصویر 3 ).

تصوير 3: پروفايل وزن مولكولي ليزوزيم (Ref: Alison E.Ashcroft, http://www.astbury.leeds.ac.uk/facil/MStut/mstutorial.htm )
در اینجا می توان وزن مولکولی ذره را بطور مستقیم مشاهده کرد . در تصویر علاوه بر منحنی وزن مولکولی لیزوزوم ( 7/14305 ) پیک های دیگر هم دیده می شود که مربوط به اضافه شدن یونهای دیگر [ ( 23 + M ) Na ، ( 39 + M ) K ، ( 98 +M ) H2PO4 يا H3PO4 ) است .
پروتئینها در حالت طبیعی (Negative state ) در مقایسه با حالت باز شده ( Unfolded ) تمایل کمی به نشان دادن چندین جایگاه شارژی به هنگام مس اسپکترومتری دارند . علت آنست که پروتئینها در حالت طبیعی طوری پیچش دارند که جایگاههای اضافی که قابلیت یونیزه شدن دارند پوشیده می شود . به هنگام الکترو اسپری شدن پروتئین ساختار طبیعی را از دست می دهد . بنابراین ممکن است جایگاههای اضافی قابل یونیزه شدن بارز شوند . علاوه بر این نوع حلال و pH نیز می تواند در تعیین این حالت دخیل باشند . لذا اگر یک پروتئین را در دو حلال و pH های مختلف مس اسپکترومتری کنیم خواهیم دید که الگوی اسپکترای آنها متفاوت است ( تصویر 4 ) .
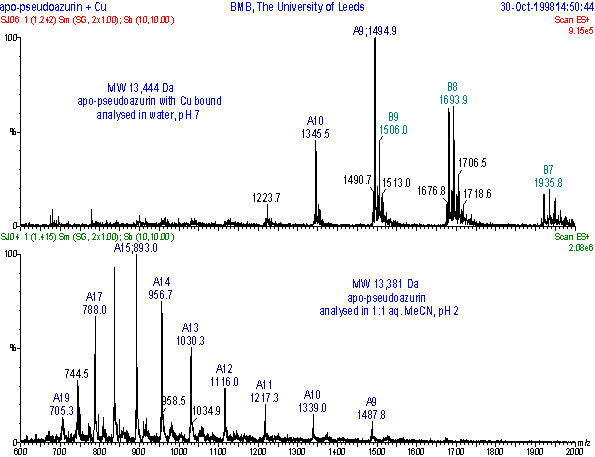
تصویر4 : اسپکترای بدست آمده از ESI – MS برای پروتئین آپوسودوآزورین در آب و 7 pH ( تصویر بالا ) و در حلال 1 : 1 استونیتریل آبی 1/0 % 2 pH ( تصویر پایین ). (Ref: Alison E.Ashcroft, http://www.astbury.leeds.ac.uk/facil/MStut/mstutorial.htm )
همچنین ممکن است پروتئین بصورت متصل با کوفاکتورها ، لیگاندها یا رسپتورها و اسیدهای نوکلئیک و … باقی بماند که این سبب تغییر وزن مولکولی محاسبه شده از مقدار واقعی می گردد .
